Закон постоянства состава вещества
Всякое чистое вещество, независимо от способа его получения, имеет постоянный количественный и качественный состав.
Качественный состав вещества показывает, из атомов каких элементов построены его молекулы. Количественный состав показывает, сколько атомов каждого элемента входит в состав молекулы (формульной единицы) вещества или массовую долю элемента в веществе. Например, молекулы аммиака (NH3) состоят из атомов химических элементов азота (N) и водорода (Н). Это качественный состав. Причем, одна молекула состоит из трех атомов Н и одного атома N. Это количественный состав. Аммиак мы можем получить многими способами:
1. N2 + 3H2 = 2NH3;
2. NH4NO3 + NaOH = NaNO3 + H2O + NH3;
3. NH4Cl 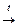 NH3+ HCl.
NH3+ HCl.
Однако, согласно закону постоянства состава, независимо от способа получения, молекула NH3 всегда будет состоять из одного атома N и трех атомов Н.
Закон постоянства состава вещества всегда выполняется лишь для веществ молекулярной структуры, т.е. для всех жидкостей, газов и твердых веществ, имеющих молекулярную кристаллическую решетку.
Для твердых веществ, имеющих атомную, ионную или металлическую кристаллическую решетку закон постоянства состава вещества часто не выполняется. Это обусловлено двумя причинами:
1. Наличием в узлах кристаллической решетки чужеродных атомов или ионов в виде примесей.
2. Наличием в кристаллической решетке различных дефектов, например, вакансий или пустот.
Количество таких дефектов, число и вид чужеродных примесных включений в кристаллической решетке вещества в этом случае будет зависеть от способа его получения. А, значит, от способа получения вещества будет зависеть и его состав.
Из закона постоянства состава вытекает важный вывод:
Соотношения между массами элементов, входящих в состав данного соединения, а также соотношения между их химическим количеством постоянны и не зависят от способа получения этого соединения и от его имеющегося количества.
В связи с этим становится возможным определять эмпирические или простейшие формулы веществ на основании значений массовых долей химических элементов, входящих в их состав. Для веществ немолекулярного строения в роли эмпирических формул выступают их формульные единицы.
Закон кратных отношений
Если два элемента образуют между собой несколько молекулярных соединений, то массы одного элемента, приходящиеся на одну и ту же массу другого, относятся между собой как небольшие целые числа.
Пример 1. Найдем эмпирическую формулу вещества, состоящего из атомов натрия, фосфора и кислорода, массовые доли, которых в нем составляют, соответственно: 42,073%; 18,903% и 39,024%.
Дано:
ω,%(Na) = 42,073; ω,%(P) = 18,903; ω,%(O) = 39,024.
Найти: Эмпирическую формулу NaxPyOz - ?
Решение:
Массовые доли элементов (Э), выраженные в %, численно соответствуют массе атомов этих элементов m(Э) в 100 граммах вещества. Следовательно, если у нас имеется 100 г вещества, то массы содержащихся в нём элементов Na, P и О будут соответственно равны 42,073 г; 18,903 г и 39,024 г. Воспользуемся отношением
 , где
, где
n(Э) – количество вещества; число моль атомов элемента Э, моль;
m(Э) – масса атомов химического элемента, г;
M(Э) – масса одного моль атомов химического элемента Э, г/моль.
 ;
;  ;
;
 .
.
В одном моль вещества число моль атомов каждого элемента (n(Na), n(P), n(O)) будет целым числом, но соотношение между ними будет такое же, как и в 100 граммах вещества. Представим в связи с этим соотношение между n(Na), n(P) и n(O) как соотношение простых целых чисел, наблюдающееся в одном моль вещества.
n(Na) : n(P) : n(O) = 1,8 : 0,6 : 2,4
Разделим каждый член этого соотношения на 0,6.
n (Na) : n (P) : n (O) = 1,8/0,6 : 0,6/ 0,6 : 2,4/ 0,6 = 3 : 1 : 4.
В таком же количественном соотношении атомы Na, Р и О находятся в веществе: x = 3, y = 1, z = 4.
Простейшая его формула Na3РО4.
Ответ: Эмпирическая формула вещества: Na3РО4.
Для большинства веществ немолекулярной структуры такие эмпирические формулы совпадают с формульными единицами этих веществ. У веществ молекулярной структуры их истинная, т.е. молекулярная формула не всегда совпадает с установленной таким образом эмпирической формулой. В этом случае для нахождения истиной (молекулярной) формулы вещества необходимо знать его молярную или молекулярную массу.
Пример 2. Найдем молекулярную формулу углеводорода, массовые доли углерода и водорода в котором, соответственно, равны 85,72% и 14,28%, а его относительная молекулярная масса равна 28.
Дано:
ω,%(С) = 85,72; ω,%(Н) = 14,28; Мr(углеводорода) = 28.
Найти: Молекулярную формулу углеводорода, СxHy - ?
Решение:
Найдем число моль атомов С и Н, содержащихся в 100 граммах углеводорода.
 ,
,  .
.
Представим соотношение между n(С) и n(Н) как соотношение простых целых чисел:
n(C) : n(H) = 7,14 : 14,28 = 7,14/7,14 : 14,28/7,14 = 1 : 2; х = 1, y = 2.
Значит, эмпирическая формула вещества СxHy – СН2.
Найдем относительную молекулярную массу СН2: сложив относительные атомные массы всех атомов, входящих в состав молекулы.
Mr(CH2) = Ar(C) + 2·Ar(H) = 12 + 1 × 2 = 14.
Определим соотношение между Mr(углеводорода) и Mr(CH2):
 .
.
Это значит, что численное значение индексов x и y в молекулярной формуле в 2 раза больше, чем в эмпирической. Таким образом, молекулярная формула вещества равна С2Н4.
Ответ: Молекулярная формула углеводорода С2Н4.
Пример 3. При взаимодействии азота с кислородом образуются пять оксидов. На 1 грамм азота в образующихся молекулах приходится 0,57, 1,14, 1,71, 2,28, 2,85 грамма кислорода. Выведите молекулярные формулы образующихся оксидов.
Дано:
1 г (N) : 0, 57 г (О); 1 г (N) : 1,14 г (О); 1 г (N) : 1,71 г (О); 1 г (N): 2,28 г (О); 1 г (N): 2,85 г (О).
Найти: NxOy образующихся оксидов - ?
Решение:
По закону кратных отношений, на 1 г N в оксидах приходится О: 0,57 г, 1,14 г, 1,71 г, 2,28 г, 2,85 г. Эти массы кислорода относятся как простые целые числа:
0,57 : 1,14 : 1,71 : 2,28 : 2,85 =  .
.
Для установления формулы, например, для первого оксида берут не массы, а количества веществ. Так в первом оксиде NxOy x : y = n (N) : n (O) =  .
.
Полученному отношению 2:1 соответствует оксид состава: N2O. Формулы для остальных оксидов установите самостоятельно*.
Ответ: N2O, (NO, N2O3, NO2, N2O5) *.