| К группе гемопротеинов относятся гемоглобин и его производные, миоглобин, хлорофиллсодержащие белки и ферменты (вся цитохромная система, каталаза и пероксидаза). Все они содержат в качестве небелкового компонента структурно сходные железо- (или магний) порфирины, но различные по составу и структуре белки, обеспечивая тем самым разнообразие их биологических функций. Гемоглобин в качестве белкового компонента содержит глобин, а небелкового – гем. Видовые различия гемоглобина обусловлены глобином, в то время как гем одинаков у всех видов гемоглобина. Основу структуры простетической группы большинства гемосодержащих белков составляет порфириновое кольцо, являющееся в свою очередь производным тетрапиррольного соединения – порфирина. Последний состоит из четырех замещенных пирролов, соединенных между собой метиновыми мостиками (—СН=). Незамещенный порфирин называется порфином. В молекуле гема порфин представлен в виде протопорфирина IX, содержащего четыре метильные группы (—СН3), две винильные группы (—СН=СН2) и два остатка пропионовой кислоты. Протопорфирин, присоединяя железо, превращается в гем. Гем в виде гем-порфирина является простетической группой не только гемоглобина и его производных, но и миоглобина, каталазы, пероксидазы и цитохромов b, с и c1.
Атом железа расположен в центре гема-пигмента, придающего крови характерный красный цвет. Каждая из 4 молекул гема «обернута» одной полипептидной цепью. В молекуле гемоглобина взрослого человека HbА (от англ. adult – взрослый) содержатся четыре полипептидные цепи, которые вместе составляют белковую часть молекулы – глобин. Две из них, называемые α-цепями, имеют одинаковую первичную структуру (по 141 аминокислотному остатку). Две другие, обозначаемые β-цепями, также идентично построены (содержат по 146 аминокислотных остатков). Таким образом, вся молекула белковой части гемоглобина состоит из 574 аминокислот. Во многих положениях α- и β-цепи содержат разные аминокислотные последовательности, хотя и имеют почти одинаковые пространственные структуры.
Миоглобин –содержится в красных мышцах и участвует в запасании кислорода. В условиях интенсивной мышечной работы, когда парциальное давление кислорода в ткани падает, О2 освобождается из комплекса с миогобином и используется в митохондриях клеток для получения необходимой для работы мышц энергии.
Гемоглобины – структурно-родственные белки, находящиеся в эритроцитах позвоночных. Онивыполняют две важные биологические функции:
1) переносят О2 из легких к периферическим тканям;
2) переносят СО2 и протоны от периферических тканей к дыхательным органам для последующего выведения из организма.
Гемоглобин связывает четыре молекулы кислорода на тетрамер (по одной на гем в каждой субъединице); особенно важным отличием его от миоглобина является характерная кривая насыщения кислородом, которая имеет сигмоидную форму.
Таким образом, способность гемоглобина связывать О2 зависит от того, содержатся ли в данном тетрамере другие молекулы О2. Если да, то последующие молекулы О2 присоединяются легче. Следовательно, для гемоглобина характерна кинетика кооперативного связывания, благодаря которой он связывает максимальное количество О2 в легких
и отдает максимальное количество О2 при тех Ро, которые имеют место в периферических тканях.
Гемоглобин не только переносит кислород от легких к периферическим тканям, но и ускоряет транспорт СО2 от тканей к легким. Гемоглобин связывает СО2 сразу после высвобождения кислорода; примерно 15% СО2, присутствующего в крови, переносится молекулами гемоглобина. Находящаяся в эритроцитах карбоангидраза катализирует превращение поступающего из тканей СО2 в угольную кислоту. Угольная кислота быстро диссоциирует на бикарбонат-ион и протон, причем равновесие сдвинуто в сторону диссоциации. Для предотвращения опасного повышения кислотности крови должна существовать буферная система, способная поглощать избыток протонов. Гемоглобин связывает два протона на каждые четыре освободившиеся молекулы кислорода и определяет буферную емкость крови. В легких идет обратный процесс: присоединение кислорода к дезоксигемоглобину сопровождается высвобождением протонов, которые связываются с бикарбонат-ионами, переводя их в угольную кислоту. Далее эффективно действующая карбоангидраза катализирует превращение угольной кислоты в углекислый газ, выдыхаемый из легких. Таким образом, связывание кислорода тесно сопряжено с выдыханием СО2. Это обратимое явление известно как эффект Бора. Эффект Бора является свойством тетрамерного гемоглобина и определяется гем-гемовым взаимодействием, лежащим в основе кооперативных эффектов. У миоглобина эффект Бора не обнаруживается.
Наиболее распространенные гемоглобины имеют следующую тетрамерную структуру:
· НЬА (нормальный гемоглобин взрослого человека) – α2β2. Это основной гемоглобин взрослого организма, составляет около 98% от общего количества гемоглобина;
· HbA2 (минорный гемоглобин взрослого человека) – α2δ2 Он находится в организме взрослого человека в меньшей концентрации, на его долю приходится около 2% общего гемоглобина;
· Гемоглобин АIc – гемоглобин А, модифицированный ковалентным присоединением к нему глюкозы (гликозилированный гемоглобин);
· Эмбриональный гемоглобин – синтезируется в эмбриональном желточном мешке через несколько недель после оплодотворения – ξ2ε2. Через 2 недели после формирования печени плода в ней начинает синтезироваться гемоглобин F;
· HbF (фетальный гемоглобин) – α2γ2;
· HbS (гемоглобин при серповидно-клеточной анемии) – α2S2.
Четвертичная структура наделяет гемоглобин дополнительными важными особенностями (отсутствующими у миоглобина), которые способствуют выполнению гемоглобином его уникальной биологической функции и обеспечивают возможность строгой регуляции его свойств.
|
|   А Б А Б
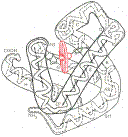
| | Модель третичной структуры молекулы миоглобина(по Дж. Кендрью). Латинскими буквами обозначены структурные домены, красным цветом – гем.
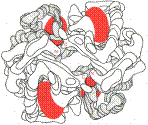
| А. Модель гемоглобина (по Перутцу).
α-Цепи светлые; β-цепи темные; группы гема красные.
Б.В центре молекулы гемоглобина формируется «центральная полость».
|
| Строение гема, входящего в состав гемоглобина и миоглобина
| 
| | Кривые ассоциации кислорода для гемоглобина и миоглобина в зависимости от парциального давления кислорода
| 
| Из графика видно, что гемоглобин имеет значительно более низкое сродство к О2. Полунасыщение гемоглобина О2 наступает при более высоком давлении кислорода (около 26 мм рт.ст.). Парциальное давление кислорода в артериальной крови составляет около 100 мм рт. ст., в венозной крови около 40 мм рт. ст., в капиллярах кровеносных сосудов активной мышцы – около 20 мм рт. ст.; минимальное давление, необходимое для функционирования ферментов цитохромной системы, равно ~5 мм рт. ст. Из рисунка видно, что ассоциация цепей с образованием тетрамерной структуры приводит к существенному повышению эффективности снабжения тканей кислородом по сравнению с мономерными белками.
Ход кривой насыщения гемоглобина кислородом или диссоциации оксигемоглобина зависит от ряда факторов:
1. Сродство гемоглобина к кислороду в первую очередь связано с рН. Чем ниже рН, тем меньше способность гемоглобина связывать кислород и тем выше Р50. В тканевых капиллярах рН ниже (поступает большое количество СО2), в связи с чем гемоглобин легко отдает кислород. В легких СО2 выделяется, рН повышается и гемоглобин активно присоединяет кислород.
2. Способность гемоглобина связывать кислород зависит также от температуры. Чем выше температура (в тканях температура выше, чем в легких), тем меньше сродство гемоглобина к кислороду. Напротив, снижение температуры вызывает обратные явления.
3. Количество гемоглобина в крови, а также в какой-то мере его способность связывать кислород (характер кривой диссоциации оксигемоглобина) несколько меняются с возрастом. Например, у новорожденных содержание гемоглобина доходит до 20-21% (вместо обычных для взрослого 13-16%). У человека имеется несколько гемоглобинов, которые образуются в различном количестве в разные стадии онтогенеза и различаются по своему сродству к кислороду.
Содержание гемоглобина А в крови взрослого здорового человека:
· женщины - ………
· мужчины - ……...
|


 А Б
А Б

