Сульфідна система аналізу катіонів
Сульфідна система аналізу катіонів є класичною. Вона базується на розділенні найбільш поширених катіонів шляхом переведення їх в осади у вигляді сульфідів, хлоридів та карбонатів. За цією системою катіони поділяють на п’ять аналітичних груп.
Аналітичною групою називається така група йонів, яка може бути відокремлена від інших дією певного реагенту, з яким ця група йонів реагує однотипно. А такий реагент, спільний для даної групи йонів, називається груповим реагентом.
За цією системою до першої аналітичної групи катіонів відносять катіони Na+, K+, NH4+, Mg2+. Ця група не має групового реагенту. Кожен катіон цієї групи виявляється своїми характерними реакціями, які виконуються в певній послідовності.
До другої аналітичної групи відносять катіони Ba2+, Sr2+, Ca2+. Груповим реагентом цієї групи катіонів є амоній карбонат (NH4)2CO3 в амоніачному буферному розчині (NH3·H2О+NH4Cl). При дії групового реагенту катіони другої аналітичної групи осаджуються у вигляді малорозчинних у воді карбонатів.
ДР(BaCO3)=4,0·10–10; ДР(SrCO3)=1,1·10–10; ДР(CaCO3)=3,8·10–9.
Катіони цієї аналітичної групи не осаджуються амоній сульфідом чи сульфідною кислотою, оскільки сульфіди цих елементів у водному розчині повністю гідролізуються. Гідроліз відбувається як за катіоном, так і за аніоном:
MeS + 2HOH  Me(OH)2 + H2S.
Me(OH)2 + H2S.
Гідроксиди цих металів досить добре розчинні у воді, особливо гідроксид Ba(OH)2, розчин якого є лугом.
До третьої аналітичної групи відносять катіони Al3+, Cr3+, Fe3+, Fe2+, Ni2+, Co2+, Mn2+, Zn2+ та ін.
Груповим реагентом цієї аналітичної групи є розчин (NH4)2S. В нейтральному чи лужному середовищі (рН=7-9) при дії групового реагенту випадають в осад малорозчинні у воді сульфіди чи гідроксиди цих металів:
| ДР(Al(OH)3)=3,2·10–34 | ДР(Fe2S3)≈1·10–88 |
| ДР(Cr(OH)3)=6,3·10–31 | ДР(FeS)=5,0·10–18 |
| ДР(Fe(OH)3)=6,3·10–38 | ДР(NiS)=3,2·10–19 |
| ДР(Fe(OH)2)=7,2·10–16 | ДР(β-CoS)=1,9·10–27 |
| ДР(Ni(OH)2)=2,0·10–15 | ДР(MnS)=2,5·10–10 |
| ДР(Co(OH)2)=4,0·10–45 | ДР(ZnS)=1,6·10–24 |
| ДР(Mn(OH)2)=1,9·10–13 | |
| ДР(Zn(OH)2)=1,4·10–17 |
Гідроксиди Fe(OH)3, Fe(OH)2, Ni(OH)2, Co(OH)2, Mn(OH)2, Zn(OH)2 за даних умов практично не утворюються, оскільки сульфіди цих металів мають меншу розчинність, ніж гідроксиди, і реакція йде з утворенням сульфідів Феруму, Ніколу, Кобальту, Мангану, Цинку.
Катіони третьої аналітичної групи не осаджуються гідроген сульфідом з кислих розчинів у вигляді сульфідів.
До четвертої аналітичної групи відносять йони Cu2+, Cd2+, Hg2+, Bi3+, As3+, AsV, SbV, Sb3+, Sn2+, SnIV та інші. Груповим реагентом катіонів цієї аналітичної групи є розчин H2S у присутності хлоридної кислоти. У кислому середовищі при рН=0,5 катіони четвертої аналітичної групи осаджуються при дії групового реагенту у вигляді практично нерозчинних у воді і мінеральних кислотах сульфідів:
ДР(CuS)=6,3·10–36; ДР(CdS)=1,6·10–28; ДР(HgS)=1,6·10–52; ДР(Bi2S3)=1,0·10–9; ДР(SnS)=2,5·10–27.
Сульфіди CuS, CdS, Bi2S3, HgS не розчиняються у розчині натрій сульфіду та в розчині амоній полісульфіду (NH4)2Sx. Сульфіди As2S3, Sb2S3, SnS та деякі інші добре розчиняються у розчині натрій сульфіду з утворенням тіосолей.
Тіосолі являють собою солі відповідних тіокислот, які утворюються при заміщенні атомів Оксигену в оксигенвмісних кислотах на атоми Сульфуру.
Наприклад:
SnS2 + Na2S  Na2SnS3;
Na2SnS3;
натрій тіостанат
Sb2S3 + 3Na2S  2Na3SbS3.
2Na3SbS3.
натрій тіостибіт
Тіосолі добре розчинні у воді, тому легко відділяються від осаду сульфідів Купруму, Кадмію, Меркурію, Бісмуту.
До п’ятої аналітичної групи відносять катіони Ag+, Hg22+, Pb2+ та інші. Груповим реагентом на катіони цієї групи є розчин хлоридної кислоти молярної концентрації еквівалента 2моль/дм3. При дії групового реагенту на катіони п’ятої аналітичної групи утворюються малорозчинні у воді і в розведених кислотах відповідні хлориди:
ДР(AgCl)=1,78·10–10; ДР(Hg2Cl2)=1,33·10–18; ДР(PbCl2)=1,6·10–5.
Систематичний хід аналізу катіонів за сульфідною системою починається з осадження катіонів п’ятої аналітичної групи розчином хлоридної кислоти (с( 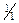 )=2моль/дм3) з наступним відділенням осаду хлоридів цих елементів.
)=2моль/дм3) з наступним відділенням осаду хлоридів цих елементів.
Потім осаджується четверта аналітична група катіонів дією розчином сульфідної кислоти у присутності хлоридної кислоти. Осад сульфідів відділяють від розчину і аналізують.
Після відділення катіонів п’ятої та четвертої аналітичних груп, діють розчином амоній сульфіду в амоніачному буферному розчині при рН=7-9. Осад гідроксидів та сульфідів катіонів третьої аналітичної групи відділяють від розчину, а потім аналізують.
Розчин солей катіонів першої та другої аналітичних груп випарюють при додаванні оцтової кислоти. При цьому амоній сульфід ((NH4)2S) розкладається, а надлишок солей амонію видаляють. Потім катіони другої аналітичної групи осаджують діючи розчином амоній карбонату у присутності амоніачного буфера. Осад карбонатів катіонів другої аналітичної групи відділяють від розчину та аналізують, а в розчині виявляють катіони першої аналітичної групи.
Сульфідна система аналізу катіонів застосовується вже дуже давно. Вона має багато переваг над іншими системами аналізу катіонів, проте є і суттєві недоліки. Серед них слід відмітити наступні:
– розчинність сульфідів деяких катіонів третьої та четвертої аналітичних груп має близькі значення, тому розділення катіонів є неповним;
– осадження сульфідів четвертої групи часто супроводжується співосадженням катіонів третьої групи;
– внаслідок проходження через багато стадій у кінцевому розчині вміст катіонів першої аналітичної групи стає дуже низьким, що викликає труднощі їх виявлення;
– для проведення повного аналізу витрачається багато часу
(до 25-30 годин);
– у методі застосовується отруйний гідроген сульфід та сульфіди, що вимагає спеціальних умов техніки безпеки при проведенні аналізів.