Электрод сравнения -это электрод,потенциал которого. 1. Электрохимическая схема электрода (полуэлемента) описывает:
Образцы тестов.
ЭДС
Вариант 1
Часть А
1. Электрохимическая схема электрода (полуэлемента) описывает:
1) окислительно-восстановительную способность пары металл-катион
2) зависимость электродного потенциала от активности ионов
3) зависимость электродного потенциала от температуры
4) составэлектрода-металла и раствора
2. Величина потенциала никелевого электрода в 0,01 М растворе Ni(NO3)2 при Т=298К (е0=-0,25В) равна:
1) -0,309В
2) -0,191В
3) -0,220В
4) -0,280В
3. В порядке увеличения восстановительных свойств металлы расположены в ряду:
1) Na, Zn, Mg
2) Al, Ca, Ni
3) Hg, Al, Mg
4) Cu, Li, Al
4. Какое утверждение ошибочно :водородный электрод
1) характеризуется электродным потенциалом, определяющимся по формуле:
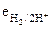 = + 0,059 рН
= + 0,059 рН
2) относится к газовым электродам
3) характеризуется полуреакцией Н2«2Н++2е-
4) описывается электрохимической схемой: Pt,H2|2Н+
5. Какое утверждение ошибочно: хлорсеребряный электрод:
1) относится к обратимым электродам II рода
2) описывается электрохимической схемой: Ag| AgCl, Сl¯
3) характеризуется полуреакцией AgCl+ le- « Ag° + CI-
4) используется для определения pH биологических жидкостей как электрод определения
(индикаторный)
Электрод сравнения -это электрод,потенциал которого
1)применяется для характеристики окислительно-восстановительных свойств природных
соединений
2)практически постоянен и не зависит от протекания побочных реакций
3) зависит от активности (концентрации) анализируемых ионов
4) возникает в системе, состоящей из инертного металла и раствора, содержащего окислительно-восстановительную систему
7. Стеклянный электрод с Н+-функцией может использоваться для потенциометрического определения:
1)концентраций Na+ и Н+
2) только концентраций Na+
3) только концентраций Н+
4) концентраций катионов любого металла
8. Какое утверждение ошибочно: стеклянный электрод
1) имеет стеклянную мембрану (шарик) из специального стекла-литийбарий силикатного
2) используется как электрод определения при потенциометрическом определении рН
3)окислительно-восстановительный
4) описывается электрохимической схемой
Ag|AgCl |0,1 М раствор HClúстеклянная мембрана
внутренний внутренний
электрод раствор
сравнения
9. Окислительно-восстановительный потенциал - это скачок потенциала, возникающий:
1)на границе инертный металл-раствор, содержащий окислительно – восстановительную систему
2) на границе металл-раствор соли этого металла
3) вследствие различий в скоростях диффузии катионов и анионов
4) между сторонами мембраны с избирательной проницаемостью
10. Величина окислительно-восстановительного потенциала зависит от рН для следующей полуреакции:
1) Ag+ +1e- « Ago
2) Fe(CN) 63- + 1e-« Fe(CN)64-
3) Co+3 +1e- « Co+2
4)НАД+ + Н++2е- « НАДН
11. По международному соглашению (Стокгольм, 1953 г.) электрохимическая схема цепи (элемента) записывается:
1) справа - электрод с большим значением потенциала
2) справа – электрод с положительным значением потенциала
3) справа - электрод с меньшим значением потенциала
4) справа - можно поместить любойиз 2-х используемых электродов