Раздел I. ХИМИЯ БЕЛКОВ. ФЕРМЕНТЫ
Белки играют важную роль в построении живой ткани и в осуществлении процессов жизнедеятельности. Особенности структуры и наличие ряда уникальных свойств обеспечивают функционирование белков как одного из основных материальных носителей жизни. Представление о структуре, физико-химических свойствах и биологических функциях белков являются теоретической основой изучения всех последующих разделов биологической химии.
Ферменты – это биологические катализаторы, характеризующиеся высокой активностью и специфичностью. Благодаря этим свойствам ферментативный катализ выступает в качестве механизма биологической регуляции химических процессов в живой клетке. Закономерности биохимических процессов можно понять только на базе четких представлений о структуре и свойствах катализирующих их ферментов.
В клинико-лабораторной практике широко используется определение активности ферментов в крови, моче и клетках для диагностики и прогнозирования течения многих заболеваний, а также для контроля за эффективностью применяемых методов лечения.
ЦЕЛЬ ИЗУЧЕНИЯ ТЕМЫ: уметь использовать знания о структуре и функциональном многообразии белков, об изменении белкового состава органов и тканей в норме и при болезнях для объяснения нормальных функций организма и их нарушений при патологии. Применять знания о свойствах ферментов и ферментативном составе органов и тканей при последующем изучении метаболизма и функций органов и для решения вопросов диагностики.
ЗАДАЧИ ИЗУЧЕНИЯ РАЗДЕЛА:
– усвоить понятие о первичной структуре полипептидной цепи;
– конформации полипептидной цепи;
– вторичной структуре фрагмента полипептидной цепи;
– третичной структуре полипептидной цепи;
– четвертичной структуре молекулы белка;
– химические и энергетические особенности связей и взаимодействий, стабилизирующих различные уровни организации молекулы;
– принцип классификации белков;
– современные представления о функции белков в организме;
– современные представления о химической природе и структуре ферментов;
– взаимосвязь между структурой и свойствами ферментов;
– современные представления о регуляции активности ферментов;
– принципы кооперативного действия ферментов в живой клетке;
– клинические аспекты ферментологии.
Тема 1.1. СТРУКТУРА И СВОЙСТВА АМИНОКИСЛОТ.
АМИНОКИСЛОТНЫЙ СОСТАВ БЕЛКОВ.
Вопросы для самоподготовки
1. Что является основной структурной единицей белков?
2. Сколько аминокислот участвует в построении белков всех видов живых существ – от бактерии до человека?
3. Напишите общую формулу α-аминокислоты.
4. Наличие какого атома углерода в молекуле α-аминокислоты обусловливает ее оптическую активность?
5. Напишите формулы D- и L-стереоизомеров аминокислоты (на примере любой аминокислоты), указав принципы, лежащие в основе отношения их к D- или L-ряду.
6. Какая форма стереоизомеров α-аминокислот участвует в построении белковых молекул, свойственных организму?
7. Что в структуре α-аминокислот обусловливает их химическую индивидуальность?
8. По каким свойствам отличаются радикалы аминокислот?
9. Как классифицируются аминокислоты по строению бокового радикала?
10. Напишите формулы алифатических незамещенных аминокислот (моноаминомонокарбоновых).
11. Напишите формулы алифатических замещенных гидроксиаминокислот.
12. Напишите формулы алифатических замещенных тиоаминокислот.
13. Напишите формулы алифатических замещенных карбоксиаминокислот (моноаминодикарбоновых кислот).
14. Напишите формулы алифатических замещенных диаминокислот (диаминомонокарбоновых кислот).
15. Напишите формулы ароматических аминокислот.
16. Напишите формулы гетероциклических аминокислот.
17. Напишите формулу циклической иминокислоты.
18. На какие три группы делятся аминокислоты по полярности их радикала?
19. Напишите формулы аминокислот с неполярным радикалом.
20. Напишите формулы α-аминокислот с полярными, но незаряженными радикалами.
21. Напишите формулы α-аминокислот с отрицательно заряженными радикалами.
22. Напишите формулы α-аминокислот с положительно заряженными радикалами.
23. На какие две группы делятся аминокислоты по их физиологическому (биологическому) значению?
24. Напишите формулы незаменимых аминокислот.
25. Какие вещества называются амфолитами?
26. В виде каких частиц находятся α-аминокислоты в водных растворах при нейтральном значении рН?
27. Как влияет на заряд растворенных аминокислот изменение рН среды?
28. Какой заряд имеют аминокислоты в кислой среде?
29. Какой заряд имеют аминокислоты в основной среде?
30. Напишите формулу аминокислоты в виде иона в нейтральной, кислой и основной средах на примере аминокислоты, относящейся к группам:
1. полярных, но незаряженных;
2. заряженных отрицательно;
3. заряженных положительно;
4. незаряженных.
31. Дайте определение понятию «изоэлектрическая точка».
32. При помощи какой связи могут ковалентно связываться между собой α‑аминокислоты? Какова энергия этой связи?
33. Напишите реакцию взаимодействия: а) цистеина и треонина; б) серина и триптофана.
34. Напишите формулы трипептидов: а) пролил-глицил-аланин; б) лизил-фенилаланил-серин.
35. Какие структуры называют полипептидами?
36. Напишите возможные дипептиды, образованные аминокислотами Лиз и Сер.
37. Напишите формулу трипептида, у которого резко преобладают кислые свойства?
38. Напишите формулу трипептида, у которого преобладают основные свойства.
39. Напишите формулу трипептида, у которого преобладают неполярные свойства.
Вопросы, задачи и упражнения для самоконтроля
1. Выберите характеристики аминокислот, входящих в состав белков:
а) α-аминокислоты;
б) в состав белков входят все 20 из известных протеиногенных аминокислот;
в) различаются боковыми радикалами;
г) в составе радикала всегда имеется гидрофильная функциональная группа;
д) среди аминокислот имеется иминокислота.
2. Укажите аминокислоты, которым принадлежат следующие радикалы:
1. –СН2–СН2–СОNН2;
2. 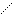 СН3 СН3
 –СН2–СН
СН3
3. –(СН2)2–S–СН3;
4. –(СН2)3–СН2NН2. –СН2–СН
СН3
3. –(СН2)2–S–СН3;
4. –(СН2)3–СН2NН2.
| а) про; б) глу; в) мет; г) лей; д) лиз; е) глн; ж) три. |
3. Классифицируйте кислоты по полярности радикалов:
| 1. илей; 2. асн; 3. глу; 4. гис; 5. сер; 6. про; 7. мет; 8. цис. | а) полярная с катионной группой; б) полярная с анионной группой; в) полярная незаряженная; г) неполярная. |
4. Напишите реакцию взаимодействия двух молекул цистеина, приводящую к образованию ковалентной дисульфидной связи за счет окисления обеих тиоловых групп. Как называется образовавшаяся аминокислота?
5. Какие нестандартные аминокислоты, встречающиеся в белках, могут образовываться путем модификации (гидроксилирования) аминокислот основного набора после их включения в полипептидную цепь?
6. Почему аспарагиновую и глутаминовую кислоты корректней называть аспартат и глутамат?
7. Какие Вы знаете незаряженные производные аспарагиновой и глутаминовой кислот? Напишите их формулы.
8. Смесь аминокислот – глицина, аланина, глутаминовой кислоты, лизина, аргинина, гистидина – анализировали с помощью метода электрофореза на бумаге в буфере с рН = 6,0. Какие из этих аминокислот будут двигаться к аноду, катоду, останутся на старте?
9. Напишите формулы аспарагиновой кислоты, серина, аргинина в нейтральной, кислой и основной средах. При разделении этих аминокислот методом электрофореза на бумаге в буфере с рН=7,0 покажите их движение (к аноду, катоду, останутся на старте).
Литература
1. Николаев А.Я. Биологическая химия. – М.: Высшая школа, 1989. – С. 9-20.
2. Березов Т.Т., Коровкин Б.Ф. Биологическая химия. – М.: Медицина, 1990. – С. 29-32, 49-50.
3. Березов Т.Т., Коровкин Б.Ф. Биологическая химия. – М.: Медицина, 1998. – С. 33-43.
4. Задания на самоподготовку по биологической химии.
5. Задания для самостоятельной работы студентов лечебного и медико-профилактического факультетов.
6. Тестовые задания по биохимии.
7. Лекционный материал.
8. Северин Е.С., Николаев А.Я. Биохимия. Краткий курс с упражнениями и задачами. – М.: ГЭОТАР-МЕД, 2001. – С. 6-8.